INTER FIX™ implants and instruments, INTER FIX™ RP implants and instruments, INTER FIX™ device + INFUSE® bone graft , INTER FIX™ RP device + INFUSE® bone graft, LT-CAGE® implants and instruments, LT CAGE® device + INFUSE® bone graft, AFFINITY® implants and instruments, cage removal instruments, BUTTERFLY™ implants, NOVUS threaded cages (international only), anterior laparoscopic instrument set, cylindrical endoscopic instrument set, ALIF guide tube instruments, PLIF guide tube instruments, LORDOTEC™ implants and instruments, PRECISION-GRAFT™ instruments, BOOMERANG® PEEK-strutted end piece, TANGENT® instrument sets that include slap hammer and chisel, UNION™ instruments, BRYAN® TCD instruments, CAPSTONE™ distractors and slap hammer, PYRAMETRIX® ADVANCE impacted distractors, TELAMON Ti (International) and TELAMON® instruments with guide tubes incorporates technology developed by Gary K. Michelson, M.D.
INTER FIX™ implants and instruments, INTER FIX™ RP implants and instruments, INTER FIX™ device + INFUSE® bone graft , INTER FIX™ RP device + INFUSE® bone graft, LT-CAGE® implants and instruments, LT CAGE® device + INFUSE® bone graft, AFFINITY® implants and instruments, cage removal instruments, BUTTERFLY™ implants, NOVUS threaded cages (international only), anterior laparoscopic instrument set, cylindrical endoscopic instrument set, ALIF guide tube instruments, PLIF guide tube instruments, LORDOTEC™ implants and instruments, PRECISION-GRAFT™ instruments, BOOMERANG® PEEK-strutted end piece, TANGENT® instrument sets that include slap hammer and chisel, UNION™ instruments, BRYAN® TCD instruments, CAPSTONE™ distractors and slap hammer, PYRAMETRIX® ADVANCE impacted distractors, TELAMON Ti (International) and TELAMON® instruments with guide tubes incorporates technology developed by Gary K. Michelson, M.D.
MD IV Bone Dowels implant methods and instruments incorporate technology developed by Gary K. Michelson, M.D. ZEPHIR™, PREMIER®, and ATLANTIS® products are licensed under one or more of G. Karlin Michelson, M.D., Patent Nos.: 6,193,721; 6,398,783; 6,454,771.
ВАЖНАЯ ИНФОРМАЦИЯ
ОТНОСИТЕЛЬНО INTER FIX™
ЦЕЛЬ:
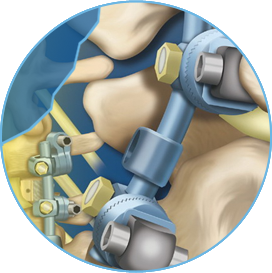
Это устройство - металлический имплант, предназначенный для межтеловой стабилизации и создания спондилодеза в послеоперационном периоде после хирургического лечения заболевания позвоночника. Кейдж должен быть имплантирован только врачом, который полностью осведомлен о его медицинском применении и хирургических аспектах, и был проинструктирован относительно механических особенностей импланта, свойств материала, возможности его применения и соответствующих ограничениях.
ОПИСАНИЕ.
INTER FIX™ резьбовой цилиндрический кейдж, изготовленный из сплава титана Ti-6AI-4v, по химическому составу соответствует стандарту Американского общества по испытанию материалов 136-84 или I.S.0.5832/3. Представлены в различные размеры кейджей соответственно анатомическим особенностям пациентов; кейджи имеют полость для размещения внутри аутогенного костного материала. Они устанавливаются в межтеловое пространство в поясничном отделе позвоночника для создания жесткости и стабилизации в период формирования спондилодеза.
ПОКАЗАНИЯ, ПРОТИВОПОКАЗАНИЯ, И ВОЗМОЖНЫЕ НЕБЛАГОПРИЯТНЫЕ ЭФФЕКТЫ.
ПОКАЗАНИЯ:
INTER FIX™ резьбовой кейдж предназначен для имплантации на уровне поясничного и пояснично-крестцового отделов позвоночника с целью создания сегментарного артродеза при
дегенеративной дископатии:
ревизионное вмешательство при неудовлетворительном результате предшествующей операции, рецидивирующей грыжи диска, послеоперационной нестабильности.
поясничный стеноз.
ложный сустав на уровне поясничного отдела,
дегенеративный или истмический спондилолистез с I степенью остаточного смещения после редукции,
боль в области поясницы.
Дополнительно детали относительно показаний даны в брошюре по хирургической технике, доступной по запросу.
ПРОТИВОПОКАЗАНИЯ:
Это устройство не предназначено для использования на уровне шейного отдела позвоночника.
Противопоказания включают следующие состояния, но не ограничиваются ими:
1. Локальная инфекция в области операционного вмешательства,
2. Симптомы местного воспаления.
3. Лихорадка или лейкоцитоз.
4. Выраженное ожирение.
5. Беременность.
6. Ментальные проблемы.
7. Другие патологические состояния или заболевания, в связи с которыми риск превышает потенциальную пользу в использовании спинальной хирургии, такие как опухолевые процессы, врожденные аномалии, переломы в зоне планируемого вмешательства, повышение СОЭ, необъясненное другими заболеваниями, повышение лейкоцитов или сдвиг лейкоцитарной формулы.
8. Быстро прогрессирующие болезни суставов, абсорбция кости, нарушение остеогенеза, остеопороз. Остеопороз является относительным противопоказанием, так как это состояние может ограничить степень возможной коррекции и качество механической фиксации.
9. Заподозренная или имевшая место в анамнезе аллергия на металл или его непереносимость.
10. Клинический случай, при котором нет потребности в костном трансплантате и спондилодезе.
11. Пациент, имеющий недостаточный объем мягких тканей в зоне оперативного вмешательства.
12. Какие-либо иные случаи, не описанные в показаниях.
13. Любой пациент, от которого можно ожидать невыполнение послеоперационных рекомендаций.
Это вид хирургического вмешательства не показан пациентам с выявленными наследственными или приобретенными состояниями, нарушающими прочностные свойства кости, а также при кальцинозе.
Не применяется в педиатрической практике и у пациентов при незавершенном росте скелета.
ПРЕДОСТЕРЕЖЕНИЕ: может использоваться только врачом или под руководством врача.
ПРИМЕЧАНИЕ: Хотя врач – хорошо информированный и компетентный посредник между компанией и пациентом, важная медицинская информация (показания, противопоказания, предостережения, меры предосторожности) данная в этом документе, должна быть передана пациенту.
Это устройство должно быть имплантировано только врачом, хорошо знакомым с особенностями кейджа, инструментарием и техникой хирургического вмешательства.
ВОЗМОЖНЫЕ НЕБЛАГОПРИЯТНЫЕ ЭФФЕКТЫ:
Неблагоприятные результаты могут встречаться как при сочетании с инструментальной фиксацией так и без таковой. Потенциальный риск неблагоприятных исходов в результате подвижности и развития нестабильности может увеличиться в случаях, когда дополнительная инструментальная фиксация не используется. Потенциальные неблагоприятные исходы включают, но не ограничены:
1. Ранняя или поздняя нестабильность или расшатывание какого-либо из компонентов.
2. Миграция импланта.
3. Поломка любых из компонентов импланта или инструментов.
4. Реакция на имплант как на инородное тела, включая возможное формирование опухоли, аутоиммунопатологическое заболевание, и/или рубцовый процесс.
5. Давление на окружающие ткани или органы, где есть недостаток ткани вокруг импланта. Имплант или вытесненные из него костные аутотрансплантаты могут привести к формированию свища.
6. Уменьшение физиологических изгибов позвоночника, снижение высоты межтелового промежутка, потеря достигнутой коррекции и/или редукции.
7. Инфекция.
8. Перелом кости или стрессовый перелом выше или ниже уровня вмешательства.
9. Формирование ложного сустава.
10. Появление неврологического дефицита, радикулопатия, разрыв дуральной оболочки и/или развитие болевого синдрома. Нейроваскулярный конфликт, включая паралич или другие типы серьезных нарушений. Ликворея.
11. Кровотечение и/или гематомы.
12. Прекращение роста фиксированной части позвоночного столба.
13. Дисцит, арахноидит и/или другие типы воспаления.
14. Тромбоз глубоких вен, тромбофлебит и/или эмболия легочной артерии.
15. Осложнения со стороны донорского участка (места взятия костного трансплантата).
16. Неспособность возобновить нормальный уровень ежедневной активности.
17. Смерть.
ФИКСАЦИЯ УСТРОЙСТВА:
Установка и позиционирование импланта выполняется только с помощью специального вспомогательного инструментария и оборудования, поставляемого и определяемого SOFAMOR DANEK. Поэтому, в интересах безопасности пациента рекомендуется, чтобы импланты SOFAMOR DANEK не использовались с устройствами других производителей.
Никогда ни при каких обстоятельствах не используйте повторно INTER FIX. Даже когда удаленное устройство кажется неповрежденным, у него могут быть небольшие дефекты или внутренние паттерны напряжения, которые могут привести к его ранней поломке.
Упаковка:
Пакеты для каждого из компонентов должны быть интактными при получении. Если партия имплантов будет использоваться, все наборы должны быть тщательно проверены на предмет соответствия и наличия всего инструментария, и все компоненты должны быть тщательно проверены для выявления признаков повреждения до начала использования. Поврежденные пакеты или импланты не должны использоваться и должны быть возвращены в SOFAMOR DANEK.
Удалите все упаковочные материалы до стерилизации. Только стерильные импланты должны быть использованы в процессе оперативного вмешательства.
Импланты и инструменты стерилизуют или рестерилизуют непосредственно перед использованием в операционной. Этот процесс должен быть выполнен перед использованием или перед возвращением имплантов в SOFAMOR DANEK.
ДЕКОНТАМИНАЦИЯ И ОЧИСТКА:
Все имплантируемые устройства, включая те, которые используются для предварительной или временной установки, или которые были предварительно установлены в области оперативного вмешательства, должны сначала быть подвергнуты деконтаминации и очистке перед стерилизацией.
Note: определенные моющие растворы, содержащие едкий натрий, формалин, глютаральдегид, отбеливатель и/или другие щелочные компоненты, могут повредить некоторые элементы системы, особенно инструменты; эти растворы не должны использоваться. Кроме того, многие инструменты требуют разборки перед очисткой: их необходимо разобрать и тщательно промыть, особенно в области узловых соединений.
Осмотр и оценка: Импланты, на которых выявлены признаки повреждения или царапины, не должны использоваться.
СТЕРИЛИЗАЦИЯ:
Если не определено в иных дополнительных рекомендациях, импланты SOFAMOR DANEK стерилизуют паром, согласно следующим параметрам:
- паровая стерилизация под давлением, температура 121˚C (250 °F), время 30 мин.
Некоторые системы Здравоохранения рекомендуют стерилизацию согласно следующим параметрам, чтобы минимизировать потенциальный риск передачи болезни Крейцфельдта-Якоба, особенно при применении хирургических инструментов, которые могли войти в контакт с центральной нервной системой.
- паровая стерилизация под давлением, температура 134˚C (273 °F), время 18 мин.
ПРЕДУПРЕЖДЕНИЯ И ПРЕДОСТОРОЖНОСТИ:
Не в каждом клиническом случае достигается хороший результат. Этот факт особенно верен в спинальной хирургии, где много обстоятельств и причин могут поставить под угрозу конечный результат.
Эта система не предназначена для изолированного применения для фиксации позвоночника. Использование этой системы без костных трансплантатов или в случаях несостоявшегося спондилодеза не будет успешно. Никакой спинальный имплант не может выдержать нагрузку на позвоночник без поддержки костного блока. В такой ситуации в конечном итоге произойдет деформация, ослабление, демонтаж и/или поломка импланта. Дооперационные и интраоперционные моменты, включая знание хирургической техники и установки импланта, являются важными составляющими в успешном использовании системы хирургом.
Правильный выбор пациента и его готовность к сотрудничеству значительно влияют на конечный результат. Например, у курящих пациентов, как показали исследования, выше частота несформировавшихся спондилодезов. Такие пациенты должны быть осведомлены относительно этого факта и предупреждены о возможности соответствующих последствий. Пациенты, страдающие ожирением, имеющие неполноценное питание и/или пациенты, злоупотребляющие алкоголем, также входят в группу риска по развитию несостоятельности спондилодеза. Такой же риск имеют пациенты со слабой мышечной системой, сниженной прочностью кости и/или параличом.
Другие дооперационные, интраоперационные и послеоперационные предупреждения.
ВЫБОР ИМПЛАНТА:
Правильный выбор размера, формы и вида импланта для каждого пациента является ключевым фактором в достижении хорошего послеоперационного результата. Металлические импланты подвергаются постоянным нагрузкам в процессе жизнедеятельности, а их прочность ограничена необходимостью адаптировать имплант к размеру и форме костных анатомических образований человека. И если не соблюдены рекомендации по выбору пациента, правильной установке импланта, послеоперационном ведении, чтобы минимизировать нагрузку на имплант, то постоянные нагрузки могут вызвать усталость металла и привести к его поломке, деформации, миграции прежде, чем процесс формирования спондилодеза будет завершен, что может способствовать ухудшению состояния и потребует преждевременного удаления элементов металлоконструкции.
Предоперационные рекомендации.
- Только пациенты, удовлетворяющие критериям, описанным в показаниях, должны быть отобраны для установки импланта.
- Нужно избегать хирургического лечения пациентов, имеющих состояния или факторы риска, указанные в противопоказаниях.
- Осторожность должна быть соблюдена при обработке и хранении имплантов. Импланты не должны царапаться или быть как-то иначе . Импланты и инструменты должны быть защищены во время хранения, особенно от коррозийных сред.
- Дополнительная информация об этой системе предоставляется по запросу.
- Так как механические составляющие довольно сложны, хирург должен быть знакомым с различными элементами конструкции заранее, перед непосредственной имплантацией, и должен лично собрать конструкцию, чтобы проверить, что все части и необходимые инструменты присутствуют, прежде, чем начинается хирургическое вмешательство.
- Тип конструкции, которая будет использована в данном клиническом случае, должен быть определен до начала оперативного вмешательства. Во время оперативного вмешательства для хирурга должен быть доступен размерный ряд имплантов, включая большие и меньшие размеры относительно тех, что планировалось использовать.
- Если имплант не поставляется стерильным, все элементы конструкции и инструменты должны быть очищены и стерилизованы перед использованием. В экстренных случаях дополнительные стерильные наборы должны быть доступными.
ИНТРАОПЕРАЦИОННЫЕ РЕКОМЕНДАЦИИ.
- По-возможности, инструкции, представленные в хирургической технике, должны прилагаться.
- Чрезвычайная осторожность должна быть соблюдена при манипуляциях в непосредственной близости со спинным мозгом и нервными корешками. Повреждение нервов вызовет неврологический дефицит.
- Поломка, соскальзывание и неправильное применение инструментов или имплантов могут вызвать дополнительное повреждение тканей пациента или травму операционного персонала.
- Для формирования надежного костного блока вокруг импланта, аутогенный костный трансплантат может использоваться. Аутогенный костный трансплантат должен использоваться для заполнения импланта.
- Костный цемент не должен использоваться, потому что этот материал сделает удаление имплантов трудным или невозможным. Высокая температура, возникающая в процессе затвердевания цемента, также может вызвать неврологические нарушения и некроз кости.
ПОСЛЕОПЕРАЦИОННЫЕ РЕКОМЕНДАЦИИ
Врачебные рекомендации пациенту, выполнение которых чрезвычайно важно.
- Четкие инструкции относительно поведения и ограничений, связанных с установкой имплантов, должны быть даны пациенту. Если частичная разгрузка рекомендуется или необходима для формирования устойчивого костного блока, пациент должен быть об этом предупрежден и знать, что в результате чрезмерной или ранней нагрузки или мышечной активности возможен перелом, деформация или развитие нестабильности элементов металлоконструкции. Риск деформации, нестабильности или перелома имплантов в период послеоперационной реабилитации может быть увеличен, если пациент чрезмерно активен, или истощен, если у пациента имеются нарушения психики, слабоумие или по иным причинам не способен использовать костыли или другие устройства дополнительной опоры. Пациент должен стараться избегать падений или внезапных толчков в область спины или на спину.
- Чтобы достичь максимально возможного положительного результата, пациент или имплант не должны подвергаться воздействию механической вибрации, которая могут ослабить конструкцию. Пациент должен быть предупрежден относительно этой возможности и проинструктирован относительно ограничений физической активности, особенно при подъеме тяжестей и скручивающих движениях, а также участия в спортивных мероприятиях. Пациенту необходимо советовать не курить и не употреблять чрезмерно алкоголь во время процесса формирования костного блока. Пациент должен быть осведомлен о постоянном физическом ограничении в движении тела - невозможности наклона или поворота на уровне формирования костного блока - и научиться компенсаторным движениям за счет других сегментов или суставов.
- Вследствие чрезмерных и повторных нагрузок на имплант спондилодез в отдаленном периоде может не сформироваться. Под действием постоянных нагрузок возможен усталостный перелом элементов металлоконструкции, их деформация и развитие нестабильности. Особенно важно, чтобы фиксированные позвоночные сегменты находились в прочном костном блоке, что должно быть установлено и подтверждено рентгенологически. Если костный блок не формируется, или если компоненты системы ослабляются, деформируются или ломаются, велика угроза развития серьезных осложнений, поэтому должно быть проведено ревизионное вмешательство с удалением имплантов.
- INTER FIX импланты - внутренние устройства фиксации, разработанные для обеспечения стабилизации зоны оперативного вмешательства на период формирования костного блока.
- Все удаленные импланты должны обрабатываться таким образом, чтобы их повторное использование в другой хирургической процедуре не было возможно.
УДАЛЕНИЕ ДОПОЛНИТЕЛЬНЫХ МЕТАЛЛОКОНСТРУКЦИЙ:
В то время как INTER FIX™ должен остаться на месте, поскольку сформировавшийся костный блок предотвратит его миграцию, могут быть причины для удаления любой другой совместно используемой внутренней металлокострукции после того, как спондилодез состоялся. Это, в частности, может быть необходимо при выявлении признаков или показаниях, связанных с коррозией, локальной реакцией ткани или болью, повреждением, деформацией, переломом или миграцией элементов металлоконструкции, дискомфортом или патологическими ощущениями, инфекцией или потерей костной массы.
В случае наличия жалоб или для дополнительной информации, пожалуйста см. страницу этого информационного листа, содержащую адрес для обращений.
Претензии на имплант:
Любой профессионал здравоохранения (например, клиент, использовавший эту систему), у кого есть любые жалобы, претензии или кто неудовлетворен качеством продукта, подлинностью, сроком службы, надежностью, безопасностью, эффективностью и/или функционированием, должен информировать дистрибьютера SOFAMOR DANEK. Далее, если любой из имплантированных INTER FIX не выполняет свои функции, (то есть не отвечает своим техническим требованиям или иначе не выполняет предназначенные функции), или есть сомнения в правильности их выполнения, необходимо немедленно сообщить об этом дистрибьютеру. Если какой-либо продукт SOFAMOR DANEK в какой-либо ситуации неправильно функционирует и, возможно, послужил непосредственной или косвенной причиной смерти или серьезной дополнительной травмы пациенту, дистрибьютер должен быть информирован как можно скорее по телефону, факсу или в письменном сообщении. Регистрируя жалобу, пожалуйста укажите точное название компонента (ов) и их количество, артикул изделия, Ваше имя и адрес, характер жалобы и уведомление о том, обращались ли Вы к дистрибьютеру.
Включает технологию, разработанную Gary K. Michelson, M.D.